化學(xué)與環(huán)境工程學(xué)院博士王奔等人在機器人仿生設(shè)計和運動控制領(lǐng)域取得重要突破
近日,深圳大學(xué)化學(xué)與環(huán)境工程學(xué)院博士王奔、中國科學(xué)院深圳先進(jìn)院研究員徐天添、香港中文大學(xué)教授張立等,在機器人仿生設(shè)計和運動控制領(lǐng)域取得重要突破。研發(fā)出基于患者自體血液、具備仿根結(jié)線蟲結(jié)構(gòu)與多模態(tài)仿生運動能力的磁驅(qū)血凝膠纖維機器人,實現(xiàn)對顱內(nèi)深部區(qū)域的精準(zhǔn)、微創(chuàng)藥物遞送(圖1)。成果于2025年5月1日發(fā)表在Nature Biomedical Engineering上。王奔為第一作者與共同通訊作者。該工作歷時超3年,化學(xué)與環(huán)境工程學(xué)院2020級本科生葉芷澄(現(xiàn)為香港中文大學(xué)博士生)、何家俊(現(xiàn)為深圳大學(xué)碩士生)等全程參與了該工作。

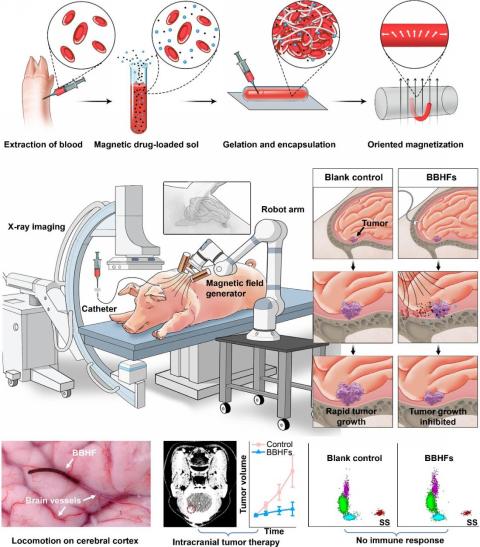
圖1.源自患者自體血液的凝膠纖維機器人用于顱內(nèi)深部操控與遞送
位于腦深部或毗鄰關(guān)鍵功能區(qū)的顱內(nèi)腫瘤,其復(fù)雜的解剖位置和高度敏感的周圍組織環(huán)境,使其在臨床治療中長期面臨巨大挑戰(zhàn)。傳統(tǒng)開顱手術(shù)需穿越重要神經(jīng)通路和血管網(wǎng)絡(luò),操作風(fēng)險極高,極易造成不可逆的神經(jīng)功能損傷和術(shù)后并發(fā)癥。放射治療雖然具備一定的非侵入性,但難以避免對健康腦組織的累積輻射損傷和腦組織壞死。化療又受限于血腦屏障,藥物難以有效到達(dá)病灶。因此,如何在不損傷正常腦組織的前提下,實現(xiàn)對深部及功能區(qū)鄰近腫瘤的高效、精準(zhǔn)、無創(chuàng)治療,已成為神經(jīng)腫瘤領(lǐng)域亟需攻克的難題。
針對上述問題,團隊開發(fā)了一種基于患者自身血液的磁驅(qū)動生物混合血液水凝膠纖維機器人。該機器人能逃避免疫系統(tǒng)識別和排斥,在可編程磁場驅(qū)動下實現(xiàn)擺動、爬行、滾動等多種仿生運動,并可通過X射線實時追蹤,實現(xiàn)顱內(nèi)腫瘤的精準(zhǔn)藥物靶向治療。
團隊突破傳統(tǒng)血管遞送路徑,利用腦脊液這一“天然航道”,設(shè)計出適應(yīng)腦脊液環(huán)境、可控多模態(tài)運動的磁驅(qū)動血液凝膠纖維機器人。其核心創(chuàng)新體現(xiàn)在三方面:材料上,采用患者自體血液中的纖維蛋白,通過仿生凝膠化技術(shù),打造與腦組織力學(xué)性能匹配的柔性載體,實現(xiàn)免疫“隱身”;運動控制上,借鑒線蟲運動機制,嵌入磁性顆粒的機器人可在外磁場下靈活運動,并結(jié)合X射線成像實現(xiàn)復(fù)雜腦區(qū)精確導(dǎo)航;藥物釋放環(huán)節(jié),利用磁致機械斷裂機制,機器人到達(dá)腫瘤后通過高強度交變磁場快速碎化,集中釋放藥物,形成局部高濃度。
該研究將生物材料、軟體機器人、醫(yī)學(xué)影像等多學(xué)科前沿技術(shù)深度融合,充分發(fā)揮深港兩地在機器人設(shè)計、仿生運動和臨床轉(zhuǎn)化等領(lǐng)域的協(xié)同創(chuàng)新優(yōu)勢,為個性化、無創(chuàng)顱內(nèi)治療開辟了全新路徑。
論文信息:Ben Wang?*, Jie Shen?, Chenyang Huang?, Zhicheng Ye, Jiajun He, Xinyu Wu, Zhiguang Guo, Li Zhang*, Tiantian Xu*, Magnetically-driven biohybrid blood hydrogel fibres for personalized intracranial tumour therapy under fluoroscopic tracking.Nature Biomedical Engineering2025, DOI: 10.1038/s41551-025-01382-z.















