醫學部黃鵬教授團隊發表雙能量代謝途徑同步干預抗腫瘤治療研究成果
近日,深圳大學醫學部生物醫學工程學院黃鵬特聘教授團隊以封面論文在藥劑學國際權威期刊Journal of Controlled Release(影響因子10.5,中科院一區,TOP期刊)上發表了題為“Oxygen-regulated enzymatic nanoplatform for synchronous intervention in glycolysis and oxidative phosphorylation to augment antitumor therapy”的研究論文。醫學部博士后江珊珊和碩士研究生李婉鈺為共同第一作者,教授黃鵬為通訊作者,深圳大學為獨立完成單位。團隊所在的生物醫學工程學科屬于廣東省優勢重點學科。


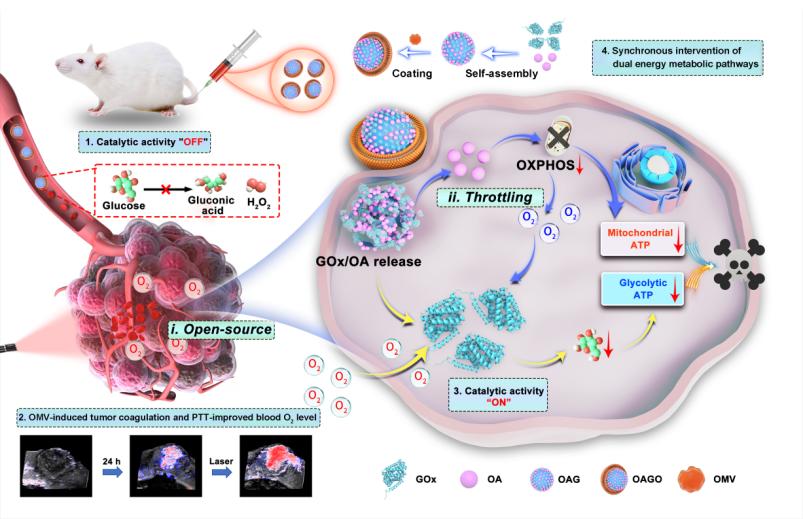
腫瘤細胞通過代謝重編程依賴糖酵解和氧化磷酸化(OXPHOS)雙重途徑獲取能量,單一代謝抑制易引發代償效應,限制治療效果。現有的雙重代謝抑制藥物存在靶向性差、毒副作用大等問題,且腫瘤微環境(TME)的缺氧特性進一步削弱了氧依賴性酶催化療法的效果。本研究提出“開源節流”的氧氣(O2)調控策略,構建了一種同步干預雙能量代謝途徑的抗腫瘤納米平臺(OAGO)。該平臺由葡萄糖氧化酶(GOx)和寡霉素A(OA)自組裝而成,并包被細菌外膜囊泡(OMVs)。OAGO在酸性TME中解離,釋放OA和GOx,恢復酶活性。通過GOx介導的糖酵解阻斷和OA誘導的OXPHOS抑制,實現雙能量代謝途徑的同步干預。GOx催化生成的過氧化氫導致腫瘤氧化應激,并加劇線粒體功能損傷。同時,抑制OXPHOS可減少O2消耗,從而改善TME中的缺氧(即“節流”策略)。OMV不僅增強OAGO在腫瘤內的蓄積,還通過破壞腫瘤血管和誘導紅細胞外滲來提高腫瘤的血氧飽和度(即“開源”策略)。此外,OMV誘導的腫瘤凝血用于體內光熱療法,進一步提升腫瘤血氧水平和局部溫度,為GOx催化提供了有利條件。在三陰性乳腺癌小鼠腫瘤模型上,OAGO表現出優異的抗腫瘤療效,揭示了O2調節與能量代謝途徑的同步干預在GOx療法中的重要性,為新型抗腫瘤治療策略的開發提供了新思路。
本研究得到國家自然科學基金、深圳市科技計劃基礎研究、深圳市醫學研究專項資金、中國博士后科學基金等項目的支持。
論文鏈接:https://www.sciencedirect.com/science/article/pii/S0168365925002032















