醫學部生物醫學工程學院教授董海峰在尋求高度靶向和高效抗癌癥治療方面取得重要研究進展,成果報道在學術期刊Angewandte Chemie International Edition上,標題為“Near-Infrared Light-Triggered Cascade Nanosystems for Spatiotemporally Controlled Gene-Silencing and Gas Synergistic Cancer Therapy”。該工作以課題組在核酸設計方面的積累為研究基礎,結合轉換納米材料技術與腫瘤生物學,實現了時空可控的抗腫瘤聯合治療。醫學部生物醫學工程學院博士后程亞如為第一作者,教授董海峰為通訊作者。

DNAzymes能夠特異性識別和切割特異性癌基因靶點,從而阻斷基因沉默治療中的蛋白質翻譯。由于其生物相容性、易于合成和高可編程性,DNAzymes在病毒感染、腫瘤和其他疾病的基因治療中得到了廣泛的探索。然而,基于DNAzymes的基因治療應用的一個主要瓶頸是,如何實現基因沉默的時空可控性。本研究開發了一種近紅外光(NIR)觸發的級聯納米系統,實現了級聯效應介導的氣體-基因協同治療,并證明了這種納米平臺在體外和體內均表現出良好的聯合抗腫瘤作用。該納米系統通過將上轉換納米顆粒(UCNPs)與一氧化氮(NO)前體結合,進一步利用靜電作用吸附具有apurinic/apyrimidinic endonuclease 1(APE1)酶激活能力的DNAzymes。UCNPs作為光轉換器,在NIR光照射下激發NO前體產生NO,而產生的NO不僅直接參與氣體治療,還將誘導細胞質中APE1水平的上調,從而增強DNAzymes的激活和時空可控的基因沉默。通過利用這一機制,將NIR光控制的NO釋放和APE1激活的基因治療的結合,實現了級聯效應介導的氣體-基因協同治療。
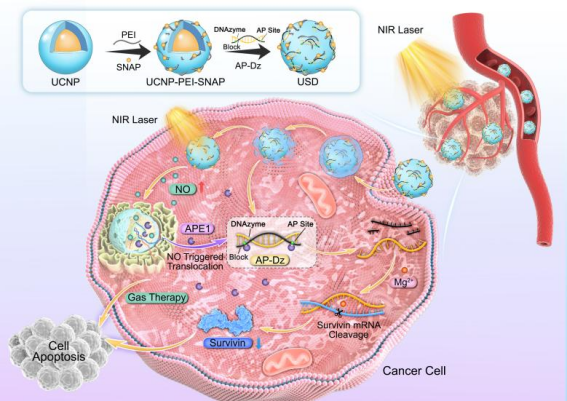
圖1.近紅外激活的級聯納米平臺的構建及其在抗腫瘤中的作用機制
該研究得到了國家重大研究計劃項目,國家自然科學基金,深圳市醫學研究專項資金項目,廣東省珠江團隊項目和中國博士后科學基金等項目的資助。
原文鏈接:https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202422375





