2024年11月,深圳大學醫學部卡爾森國際腫瘤中心朱衛國特聘教授團隊在Cell Death & Differentiation(影響因子12.4,TOP期刊,中科院一區)發表題為“hnRNPA2B1 deacetylation by SIRT6 restrains local transcription and safeguards genome stability”的研究論文,闡明了RNA結合蛋白hnRNPA2B1的去乙酰化修飾對于DNA損傷時局部轉錄抑制以及基因組穩定性的維持起到至關重要的作用。博士研究生陳鳳,碩士研究生許文超為本研究共同第一作者,醫學部助理教授張俊和特聘教授朱衛國為本文共同通訊作者。

眾所周知,DNA雙鏈的斷裂會使細胞發生快速和短暫的轉錄沉默,這一行為有利于為DNA損傷修復提供時間和空間、減少轉錄-復制沖突以及避免受損的DNA轉錄生成異常mRNA。因此,DNA損傷周圍轉錄活性的精確調節對于保持基因組穩定性和控制轉錄過程至關重要,特別是當損傷發生在活躍轉錄基因附近。然而,目前人們對于轉錄抑制過程的具體機制,以及它是如何最終達到維持基因組穩定性的目的,尚不完全清楚。
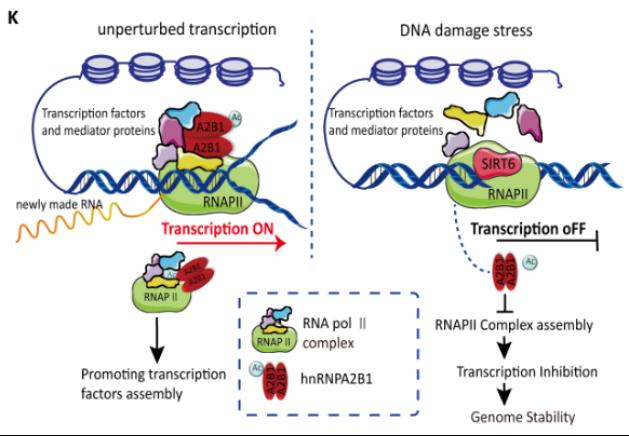
本研究揭示了RNA結合蛋白hnRNPA2B1作為一個關鍵的轉錄相關因子在正常情況下對于維持轉錄復合物的穩定性至關重要。然而,當DNA損傷發生時,hnRNPA2B1會脫離損傷位點,并進一步降低RNA聚合酶Ⅱ復合物的組裝效率,從而導致局部的轉錄抑制。機制上,該團隊鑒定出SIRT6使hnRNPA2B1在K113/173殘基上發生去乙酰化使其快速脫離DNA損傷位點,這一行為破壞了活躍染色質上RNA聚合酶Ⅱ復合物的完整性。功能研究顯示,hnRNPA2B1去乙酰化或缺失有利于DSB修復,且乙酰化模擬物對基因毒性療法更加敏感。這一事實提示可以通過抑制SIRT6活性來減少hnRNPA2B1在DNA損傷位點的脫離以增強某些特定腫瘤細胞對放化療的敏感性。這一研究結果為深入理解轉錄抑制在基因組穩定性維持過程中的具體機制提供了新思路,并為探索針對hnRNPA2B1異常表達癌癥的治療提供了潛在新策略(具體工作模式圖如下)。
本研究得到國家自然科學基金,廣東省自然科學基金以及深圳市醫學研究基金等項目的資助。
原文鏈接:https://www.nature.com/articles/s41418-024-01412-4





