2024年4月,深圳大學醫學部許興智教授團隊與山東大學汪兆琦教授團隊合作,共同在國際頂級期刊PNAS發表題為“PARP1 UFMylation ensures the stability of stalled replication forks”的研究論文。這是許興智教授團隊繼2019年首次詮釋UFM1修飾(UFMylation)在DNA損傷應答(DDR)中促進DDR核心激酶ATM活化的分子機制后,再次率先揭示了UFM1修飾維持被阻滯復制叉的穩定性,進而維持基因組穩定性的作用機理。深圳大學醫學部博士生龔亞民、助理教授王志峰和山東大學助理研究員宗文為共同第一作者,許興智教授和汪兆琦教授為共同通訊作者,深圳大學為第一單位。
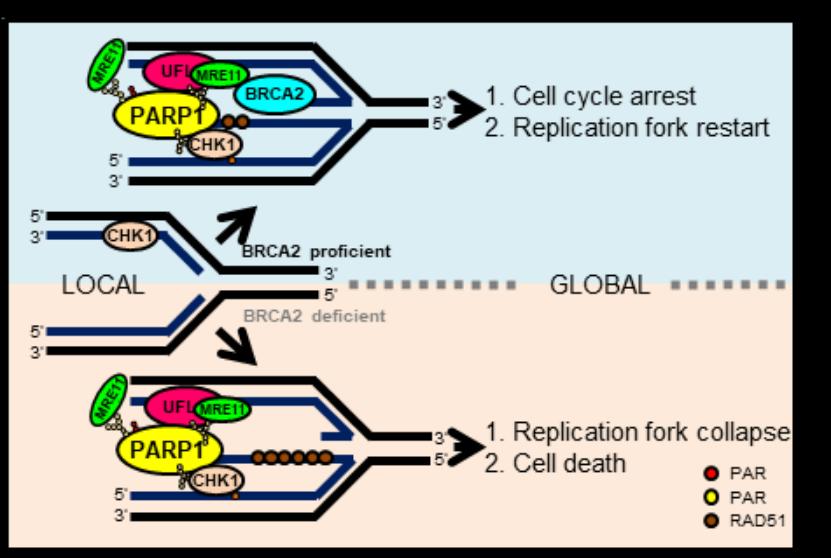
基因組DNA的高保真復制和合適的DNA復制脅迫應答是維持基因組穩定性和細胞增殖的根本保障,其異常與大多數腫瘤的發生和發展密切相關,因此,其調控網絡也是腫瘤治療的核心靶標。作為2004年才被發現的最新型類泛素修飾—UFM1修飾,至今被發現的修飾底物非常有限,卻已被證明在胚胎發育、內質網穩態、蛋白質量控制、DDR等生命活動中起重要作用,然而在DNA復制脅迫應答中的功能尚有待挖掘。在該研究中,許教授團隊發現UFM1修飾缺陷導致復制脅迫子下被阻滯的復制叉不穩定和染色體畸變率顯著升高,進一步發現多聚(ADP-核糖)聚合酶PARP1的548位賴氨酸(K548)發生UFM1修飾,該修飾促進PARP1的酶性活化和在復制叉上的招募、細胞周期檢驗點激酶CHK1的激活和核酸酶MRE11到被阻滯復制叉的招募,進而促進BRCA1/2缺陷細胞中核酸酶MRE11對被阻滯復制叉的降解,而在BRCA1/2正常細胞中促進被阻滯復制叉重啟,維持基因組穩定。肺癌病人的腫瘤細胞突變PARP1(F553L)展現出與UFM1修飾缺陷PARP1(K548R)相似的細胞表型。該研究成果揭示了UFM1修飾維持被阻滯復制叉穩定和基因組完整的作用機理,為基因組不穩定相關疾病的診治提供了新的潛在策略。
據悉,浙江大學劉婷教授也在Nat Chem Biol雜志發文,揭示UFL1催化PTIP的UFM1修飾,從而維持被阻滯復制叉的穩定性。
該研究依托廣東省基因組穩定性與疾病防治重點實驗室平臺,并獲得了國家自然科學基金、國家重點研發計劃、深圳科技創新委員會項目和“珠江人才計劃”引進高層次人才的資助。
原文鏈接:https://doi.org/10.1073/pnas.2322520121





